Moleküler biyolojide, mesajcı ribonükleik asit (mRNA), bir genin genetik dizisine karşılık gelen ve protein sentezi sürecinde bir ribozom tarafından okunan tek sarmallı bir RNA molekülüdür.
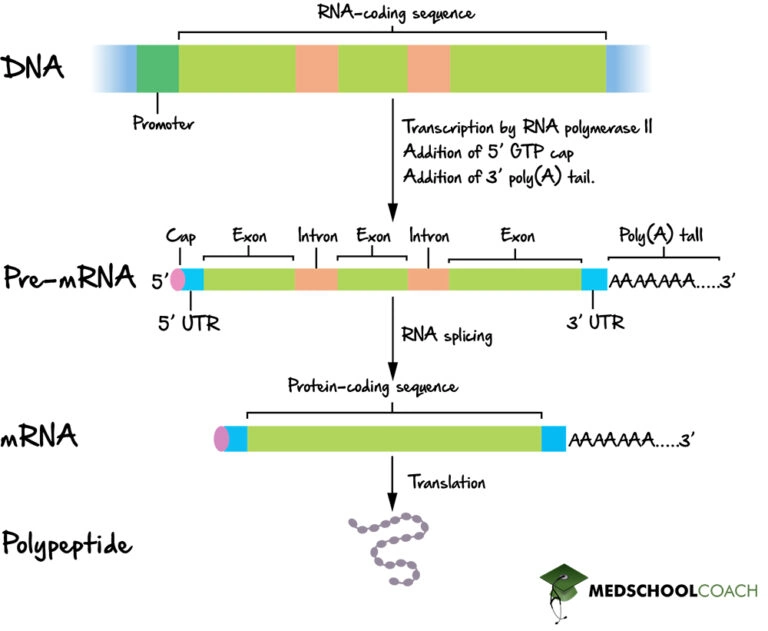
mRNA, transkripsiyon süreci sırasında oluşturulur; bu süreçte bir enzim (RNA polimeraz), geni birincil transkript mRNA'ya (pre-mRNA olarak da bilinir) dönüştürür. Bu pre-mRNA genellikle hala son amino asit dizisini kodlamayacak bölgeler olan intronları içerir. Bu intronlar, RNA splicing (RNA eklenmesi) sürecinde çıkarılır ve sadece proteini kodlayacak bölgeler olan ekzonlar kalır. Bu ekzon dizisi olgun mRNA'yı oluşturur. Olgun mRNA daha sonra ribozom tarafından okunur ve ribozom, transfer RNA (tRNA) tarafından taşınan amino asitleri kullanarak proteini oluşturur. Bu sürece translasyon (çeviri) denir. Tüm bu süreçler, biyolojik bir sistemde genetik bilginin akışını tanımlayan moleküler biyolojinin merkezi dogmasının bir parçasını oluşturur.
DNA'da olduğu gibi, mRNA'daki genetik bilgi de üç ribonükleotitten oluşan kodonlar halinde düzenlenmiş nükleotid dizisinde bulunur. Her kodon belirli bir amino asidi kodlar, stop kodonları hariç; bu kodonlar protein sentezini sonlandırır. Kodonların amino asitlere çevrilmesi, iki diğer RNA türünü gerektirir: kodonu tanıyan ve karşılık gelen amino asidi sağlayan transfer RNA (tRNA) ve ribozomun protein üretme makinesinin merkezi bileşeni olan ribozomal RNA (rRNA).
mRNA kavramı, 1960 yılında Sydney Brenner ve Francis Crick tarafından François Jacob ile yapılan bir konuşma sırasında geliştirilmiştir. 1961'de mRNA, Brenner, Jacob ve Matthew Meselson'dan oluşan bir ekip ve James Watson tarafından yönetilen bir başka ekip tarafından bağımsız olarak tanımlanmış ve açıklanmıştır. Yayına hazırlanırken verileri analiz eden Jacob ve Jacques Monod, "mesajcı RNA" adını ortaya atmışlardır.
Sentez
Bir mRNA molekülünün kısa ömrü transkripsiyonla başlar ve nihayetinde yıkımla sona erer. Yaşamı boyunca bir mRNA molekülü, translasyondan önce işlenebilir, düzenlenebilir ve taşınabilir. Ökaryotik mRNA molekülleri genellikle kapsamlı işleme ve taşımaya ihtiyaç duyar, prokaryotik mRNA molekülleri ise bu işlemlere ihtiyaç duymaz. Bir ökaryotik mRNA molekülü ve etrafındaki proteinlere birlikte "mesajcı RNP" (ribonükleoprotein) denir.
Transkripsiyon
Transkripsiyon, RNA'nın DNA'dan kopyalandığı süreçtir. Transkripsiyon sırasında, RNA polimeraz, gerektiğinde DNA'dan bir geni mRNA'ya kopyalar. Bu süreç, ökaryotlar ve prokaryotlar arasında biraz farklılık gösterir. Önemli bir fark, prokaryotik RNA polimerazın, transkripsiyon sırasında DNA işleme enzimleriyle ilişkilendirilmesidir; bu sayede işleme, transkripsiyon sırasında devam edebilir. Bu nedenle, yeni mRNA zinciri, tRNA zinciri olarak bilinen tamamlayıcı bir zincir üreterek çift sarmallı hale gelir; bu zincirler bir araya geldiklerinde baz eşleşmesiyle yapı oluşturamazlar. Ayrıca, mRNA'nın şablonu, DNA'nın bağlandığı antikodon dizisiyle aynı olan tRNA'nın tamamlayıcı dizisidir. Kısa ömürlü, işlenmemiş veya kısmen işlenmiş ürün, öncül mRNA veya pre-mRNA olarak adlandırılır; tamamen işlendiğinde olgun mRNA olarak adlandırılır.
Timin yerine urasil kullanımı
mRNA, DNA'daki timin (T) yerine urasil (U) kullanır. Urasil (U), transkripsiyon sırasında timin (T) yerine adenine (A) tamamlayıcı baz olarak görev yapar. Dolayısıyla, RNA'yı oluşturmak için bir DNA şablon zinciri kullanıldığında, timin yerine urasil konur. Bu değişiklik, mRNA'nın DNA'dan ribozoma uygun genetik bilgiyi taşımasına olanak tanır. Doğal tarih açısından urasil, timinden önce gelir; kanıtlar RNA'nın evrimde DNA'dan önce geldiğini gösterir. RNA Dünyası hipotezi, hayatın DNA genomları ve kodlanmış proteinlerin ortaya çıkmasından önce RNA molekülleriyle başladığını öne sürer. DNA'da, timinin urasil yerine evrimsel olarak kullanılması, DNA stabilitesini artırmış ve DNA replikasyonunun verimliliğini iyileştirmiş olabilir.
Ökaryotik pre-mRNA İşleme
Birleştirme (Splicing)
Olgun mRNA'ya yol açan ökaryotik pre-mRNA'nın kapsamlı işlenmesi, intronların veya outronların (kodlamayan bölgeler) çıkarıldığı ve ekzonların (kodlayan bölgeler) birleştirildiği bir mekanizma olan RNA birleştirmesidir.
5' Kap Yapısı
5' kap (aynı zamanda bir RNA kapağı, RNA 7-metilguanozin kapağı veya RNA m7G kapağı olarak da adlandırılır), ökaryotik bir mesajcı RNA'ya, transkripsiyonun başlamasından kısa bir süre sonra "ön" ya da 5' ucuna eklenmiş modifiye bir guanin nükleotididir. 5' kap, 5'-5' trifosfat bağı aracılığıyla ilk transkribe edilmiş nükleotide bağlı terminal bir 7-metilguanozin kalıntısından oluşur. Bu yapının varlığı, ribozom tarafından tanınma ve RNazlardan korunma için kritik öneme sahiptir.
Kap eklenmesi, transkripsiyonla bağlantılıdır ve transkripsiyonla birlikte gerçekleşir, böylece her biri diğerini etkiler. Transkripsiyonun başlamasından kısa bir süre sonra, sentezlenen mRNA'nın 5' ucu, RNA polimeraz ile ilişkili bir kap sentez kompleksi tarafından bağlanır. Bu enzim kompleksi, mRNA kaplanması için gerekli kimyasal reaksiyonları katalize eder. Sentez, çok aşamalı bir biyokimyasal reaksiyon olarak ilerler.
Düzenleme
Bazı durumlarda, bir mRNA düzenlenir ve bu da o mRNA'nın nükleotid bileşimini değiştirir. İnsanlarda bir örnek, bazı dokularda düzenlenen, ancak diğerlerinde düzenlenmeyen apolipoprotein B mRNA'sıdır. Düzenleme, erken bir durdurma kodonu oluşturur ve bu da çevrildiğinde daha kısa bir protein üretir.
Polyadenilasyon
Polyadenilasyon, bir mesajcı RNA molekülüne poliadenilil biriminin kovalent bağlanmasıdır. Ökaryotik organizmalarda çoğu mesajcı RNA (mRNA) molekülü, 3' ucunda poliadenile edilmiştir, ancak son araştırmalar, kısa uridin uzantılarının (oligouridilasyon) da yaygın olduğunu göstermiştir. Poli(A) kuyruğu ve ona bağlı protein, mRNA'nın ekzonükleazlar tarafından yıkımına karşı korunmasına yardımcı olur. Polyadenilasyon ayrıca transkripsiyonun sonlandırılması, mRNA'nın çekirdekten dışarıya taşınması ve translasyon için de önemlidir. mRNA, prokaryotik organizmalarda da poliadenile edilebilir, bu durumda poli(A) kuyrukları ekzonükleolitik yıkımı kolaylaştırmak için kullanılır.
Polyadenilasyon, DNA'nın RNA'ya transkripsiyonu sırasında ve/veya hemen sonrasında gerçekleşir. Transkripsiyon sonlandırıldıktan sonra, mRNA zinciri RNA polimeraz ile ilişkili bir endonükleaz kompleksi tarafından kesilir. mRNA kesildikten sonra, kesim bölgesindeki serbest 3' ucuna yaklaşık 250 adenosin kalıntısı eklenir. Bu reaksiyon poliadenilat polimeraz tarafından katalize edilir. Alternatif birleştirmede olduğu gibi, bir mRNA'nın birden fazla poliadenilasyon varyantı olabilir.
Polyadenilasyon bölgesi mutasyonları da meydana gelir. Bir genin birincil RNA transkripti poli-A ekleme bölgesinde kesilir ve RNA'nın 3' ucuna 100-200 A eklenir. Eğer bu bölge değişirse, anormal derecede uzun ve kararsız bir mRNA yapısı oluşur.
Taşıma
Ökaryotlar ve prokaryotlar arasındaki bir diğer fark da mRNA taşınmasıdır. Ökaryotik transkripsiyon ve translasyon bölgesel olarak ayrıldığından, ökaryotik mRNA'ların sitoplazmaya ihraç edilmesi gerekir - bu süreç farklı sinyal yolları tarafından düzenlenebilir. Olgun mRNA'lar, işlenmiş modifikasyonları tarafından tanınır ve daha sonra kap-bağlayıcı proteinler CBP20 ve CBP80'e ve ayrıca transkripsiyon/ihracat kompleksi (TREX) ile bağlanarak nükleer porlardan ihraç edilir. Ökaryotlarda birden fazla mRNA ihracat yolu tanımlanmıştır.
Mekansal olarak karmaşık hücrelerde, bazı mRNA'lar belirli hücre altı hedeflere taşınır. Olgun nöronlarda, bazı mRNA'lar somadan dendritlere taşınır. mRNA'nın çevrildiği bir yer, sinapsların altında seçici olarak lokalize edilmiş poliribozomlardır. Arc/Arg3.1 mRNA'sı, sinaptik aktivite tarafından indüklenir ve NMDA reseptörleri tarafından üretilen sinyallerle aktif sinapsların yakınına seçici olarak lokalize olur. Diğer mRNA'lar da β-aktin mRNA gibi dış uyaranlara yanıt olarak dendritlere hareket eder. Çekirdekten ihracat için, aktin mRNA ZBP1 ile ilişkilidir ve daha sonra 40S alt birimi ile ilişkilidir. Kompleks, bir motor protein tarafından bağlanır ve sitoskeleton boyunca hedef konuma (nörit uzaması) taşınır. Sonunda, ZBP1, çevirinin başlatılması için Src tarafından fosforile edilir. Gelişen nöronlarda, mRNA'lar da büyüyen aksonlara ve özellikle büyüme konilerine taşınır. Birçok mRNA, taşınmasını belirli bir konuma hedefleyen "posta kodları" olarak adlandırılan işaretlerle işaretlenmiştir. mRNA'lar ayrıca tünel nanotüpleri adı verilen yapılar aracılığıyla memeli hücreleri arasında da transfer edilebilir.
mRNA'nın proteine çevrilmesi
Prokaryotik mRNA'nın işlenmesine veya taşınmasına gerek olmadığından, ribozom tarafından çeviri, transkripsiyonun hemen ardından başlayabilir. Bu nedenle, prokaryotik çevirinin transkripsiyonla bağlantılı olduğu ve transkripsiyon sırasında gerçekleştiği söylenebilir.
İşlenmiş ve sitoplazmaya taşınmış (yani, olgun) ökaryotik mRNA daha sonra ribozom tarafından çevrilebilir. Çeviri, sitoplazmada serbest yüzen ribozomlarda veya sinyal tanıma partikülü tarafından endoplazmik retikuluma yönlendirilerek gerçekleşebilir. Bu nedenle, prokaryotlardan farklı olarak, ökaryotik çeviri doğrudan transkripsiyonla bağlantılı değildir. Hatta bazı durumlarda, EEF1A1 mRNA/protein düzeylerinde olduğu gibi, mRNA seviyelerinin azalması, protein seviyelerinin artmasıyla birlikte görülebilir.
Yapı
Olgun bir ökaryotik mRNA'nın yapısı. Tamamen işlenmiş bir mRNA, bir 5' başlık, 5' UTR, kodlama bölgesi, 3' UTR ve bir poli(A) kuyruğu içerir.
Kodlama Bölgeleri
Kodlama bölgeleri, ribozom tarafından kod çözülen ve proteinlere çevrilen kodonlardan oluşur; ökaryotlarda genellikle tek bir protein, prokaryotlarda ise genellikle birkaç protein kodlar. Kodlama bölgeleri bir başlangıç kodonuyla başlar ve bir durdurma kodonuyla sona erer. Genel olarak, başlangıç kodonu bir AUG üçlüsüdür ve durdurma kodonları UAG ("amber"), UAA ("ochre") veya UGA ("opal")'dir. Kodlama bölgeleri, iç baz çiftleri tarafından stabilize edilme eğilimindedir; bu da bozulmayı engeller. Protein kodlamanın yanı sıra, kodlama bölgelerinin bazı kısımları pre-mRNA'da ekzonik birleşim artırıcılar veya ekzonik birleşim baskılayıcılar olarak düzenleyici diziler olarak da işlev görebilir.
Çevrilmeyen Bölgeler
Çevrilmeyen bölgeler (UTR'ler), sırasıyla başlatma kodonundan önce ve durdurma kodonundan sonra gelen ve çevrilmeyen mRNA bölümleridir; sırasıyla beş prime çevrilmeyen bölge (5' UTR) ve üç prime çevrilmeyen bölge (3' UTR) olarak adlandırılır. Bu bölgeler kodlama bölgesiyle birlikte transkribe edilir ve bu nedenle olgun mRNA'da bulunduğundan ekzondur. Çevrilmeyen bölgelere, gen ifadesinde mRNA kararlılığı, mRNA lokasyonu ve çeviri verimliliği gibi çeşitli roller atanmıştır. Bir UTR'nin bu işlevleri yerine getirme yeteneği, UTR'nin dizisine bağlıdır ve mRNA'lar arasında farklılık gösterebilir. 3' UTR'deki genetik varyantlar, RNA yapısındaki değişiklik ve protein çevirisi nedeniyle hastalık duyarlılığı ile ilişkilendirilmiştir.
mRNA'nın kararlılığı, ribonükleazlar adı verilen RNA yıkıcı enzimlere ve RNA yıkımını teşvik eden veya engelleyen ek proteinlere olan farklı afinitesi nedeniyle 5' UTR ve/veya 3' UTR tarafından kontrol edilebilir.
Çeviri verimliliği, bazen çevirinin tamamen inhibisyonu da dahil olmak üzere, UTR'ler tarafından kontrol edilebilir. 3' veya 5' UTR'ye bağlanan proteinler, ribozomun mRNA'ya bağlanma yeteneğini etkileyerek çeviriyi etkileyebilir. 3' UTR'ye bağlanan mikroRNA'lar da çeviri verimliliğini veya mRNA kararlılığını etkileyebilir.
mRNA'nın sitoplazmik lokalizasyonunun 3' UTR'nin bir işlevi olduğuna inanılmaktadır. Hücrenin belirli bir bölgesinde ihtiyaç duyulan proteinler orada da çevrilebilir; bu durumda, 3' UTR, transkriptin bu bölgeye çevrilmek üzere lokalize olmasına izin veren diziler içerebilir.
Çevrilmeyen bölgelerde bulunan bazı elemanlar, RNA'ya transkribe edildiğinde karakteristik bir ikincil yapı oluşturur. Bu yapısal mRNA elemanları, mRNA'nın düzenlenmesinde rol oynar. Örneğin, SECIS elemanı gibi bazıları, proteinlerin bağlanması için hedef olarak işlev görür. Riboswitch olarak adlandırılan bir mRNA elemanı sınıfı, küçük moleküllere doğrudan bağlanır ve katlanmalarını değiştirerek transkripsiyon veya çeviri düzeylerini değiştirir. Bu durumlarda, mRNA kendini düzenler.
Poli(A) Kuyruğu
3' poli(A) kuyruğu, pre-mRNA'nın 3' ucuna eklenen uzun bir adenin nükleotid dizisidir (genellikle birkaç yüz adet). Bu kuyruk, çekirdekten ihracatı ve çeviriyi teşvik eder ve mRNA'yı bozulmaya karşı korur.
Monosistronik ve Polisistronik mRNA
Bir mRNA molekülü, sadece tek bir protein zincirini (polipeptit) çevirmek için genetik bilgiyi içeriyorsa monosistronik olarak adlandırılır. Bu durum, çoğu ökaryotik mRNA için geçerlidir. Öte yandan, polisistronik mRNA, her biri bir polipeptide çevrilen birkaç açık okuma çerçevesi (ORF) taşır. Bu polipeptitler genellikle ilişkili bir işlevi paylaşır (genellikle nihai kompleks proteinin alt birimlerini oluştururlar) ve kodlama dizileri bir düzenleyici bölgede bir araya getirilip düzenlenir, bir promotör ve bir operatör içerir. Bakterilerde ve arkelerde bulunan mRNA'nın çoğu polisistroniktir ve insan mitokondriyal genomu da öyledir. Dikistronik veya bikistronik mRNA sadece iki proteini kodlar.
mRNA'nın Dairesel Yapısı
Ökaryotlarda mRNA molekülleri, eIF4E ve poli(A) bağlayıcı protein arasındaki bir etkileşim nedeniyle dairesel yapılar oluşturur; her ikisi de eIF4G'ye bağlanarak bir mRNA-protein-mRNA köprüsü oluşturur. Daireselleşmenin, ribozomların mRNA üzerindeki döngüsünü teşvik ettiği ve zaman açısından verimli çeviri sağladığı düşünülmektedir ve ayrıca yalnızca bozulmamış mRNA'ların çevrildiğinden emin olmak için de işlev görebilir (kısmen bozulmuş mRNA'lar tipik olarak m7G kapağı veya poli-A kuyruğu içermez).
Özellikle virüs mRNA'sında başka daireselleşme mekanizmaları da vardır. Poliovirüs mRNA'sı, 5' ucuna doğru bir yonca yaprağı bölümü kullanarak PCBP2'ye bağlanır, bu da poli(A) bağlayıcı protein ile bağlanır ve tanıdık mRNA-protein-mRNA çemberini oluşturur. Arpa sarı cüce virüsü, 5' ucundaki mRNA segmentleri ile 3' ucundaki mRNA segmentleri arasında (öpüşen sap halkaları olarak adlandırılır) bağlanma yaparak herhangi bir protein olmadan mRNA'yı daireselleştirir.
RNA virüsü genomları (mRNA olarak çevrilen + diziler), ayrıca genellikle daireselleştirilir. Genom çoğalması sırasında daireselleşme, genom çoğalma hızlarını artırmak için, ribozomun döngüsel hareketi ile benzer şekilde virüs RNA-bağımlı RNA polimerazının döngüsünü sağlar.
Yıkım
Aynı hücredeki farklı mRNA'lar, farklı ömrelere (kararlılıklara) sahiptir. Bakteri hücrelerinde, bireysel mRNA'lar birkaç saniyeden bir saate kadar hayatta kalabilir. Ancak, ömür ortalama olarak 1 ila 3 dakika arasındadır, bu da bakteriyel mRNA'nın, ökaryotik mRNA'dan çok daha az kararlı olduğunu gösterir. Memeli hücrelerinde, mRNA ömürleri birkaç dakikadan günlere kadar değişebilir. Bir mRNA'nın kararlılığı ne kadar yüksekse, o mRNA'dan o kadar fazla protein üretilebilir. mRNA'nın sınırlı ömrü, hücrenin değişen ihtiyaçlarına hızlı bir şekilde yanıt vermesine olanak tanır. Bir mRNA'nın yıkımına yol açan birçok mekanizma vardır ve bunlardan bazıları aşağıda açıklanmıştır.
Prokaryotik mRNA Yıkımı
Genel Bakış
Ökaryotik mRNA Döngüsü
Ökaryotik hücrelerde, çeviri ve mRNA yıkımı süreçleri arasında bir denge vardır. Aktif olarak çevirisi yapılan mesajlar, ribozomlar, eukaryotik başlangıç faktörleri eIF-4E ve eIF-4G, ve poly(A)-bağlanma proteini tarafından bağlanır. eIF-4E ve eIF-4G, decapping enzimini (DCP2) engeller ve poly(A)-bağlanma proteini, exosome kompleksini engeller, böylece mesajın uçlarını korur. Çeviri ve yıkım arasındaki denge, P-cisimleri olarak bilinen sitoplazmik yapıların boyutunda ve bolluğunda yansıtılır. mRNA'nın poly(A) kuyruğu, RNA üzerindeki cis-regülatör diziler ve trans-aksiyon RNA-bağlanma proteinlerinin kombinasyonu ile belirli mesajcı RNA'lara hedeflenen özel eksonükleazlar tarafından kısaltılır. Poly(A) kuyruğunun çıkarılması, mesajın dairesel yapısını bozmaya ve kap bağlanma kompleksini dengesizleştirmeye neden olabilir. Mesaj, daha sonra ya exosome kompleksi ya da decapping kompleksi tarafından yıkıma uğrar. Bu şekilde, translasyonel olarak aktif mesajlar sağlam kalırken, aktif olmayan mesajlar hızla yok edilebilir. Çevirinin nasıl durduğu ve mesajın yıkım komplekslerine nasıl teslim edildiği ayrıntılı olarak anlaşılmamıştır.
AU-Zengin Element Yıkımı
Bazı memeli mRNA'larında bulunan AU-zengin elementler, bu transkriptlerin, bu dizilere bağlanan ve poly(A) kuyruğunun çıkarılmasını teşvik eden hücresel proteinlerin etkisiyle dengesizleşmesini sağlar. Poly(A) kuyruğunun kaybı, mRNA yıkımını exosome kompleksi ve decapping kompleksi tarafından saldırının kolaylaştırılması yoluyla teşvik ettiği düşünülmektedir. AU-zengin elementler aracılığıyla hızlı mRNA yıkımı, tümör nekroz faktörü (TNF) ve granülosit-makrofaj koloni uyarıcı faktör (GM-CSF) gibi güçlü sitokinlerin aşırı üretimini önlemede kritik bir mekanizmadır. AU-zengin elementler ayrıca proto-onkogenik transkripsiyon faktörleri c-Jun ve c-Fos'un biyosentezini de düzenler.
Anlamsız Kodon Yıkımı (Nonsense-Mediated Decay)
Ökaryotik mesajlar, mesajda erken stop kodonlarının (anlamsız kodonlar) varlığını kontrol eden anlamsız kodon yıkımı (NMD) tarafından izlenir. Bu kodonlar, eksik splicing, adaptif bağışıklık sistemindeki V(D)J rekombinasyonu, DNA'daki mutasyonlar, transkripsiyon hataları, ribozom tarafından kaçarak çerçeve kayması ve diğer nedenlerle ortaya çıkabilir. Erken stop kodonunun tespiti, mRNA yıkımını 5' decapping, 3' poly(A) kuyruğu çıkarılması veya endonükleolitik cleavage yoluyla tetikler.
Küçük Müdahale Edici RNA (siRNA)
Metazoalarda, küçük müdahale edici RNA'lar (siRNA) Dicer tarafından işlenir ve RNA kaynaklı susturma kompleksi (RISC) olarak bilinen bir kompleksin içine dahil edilir. Bu kompleks, siRNA'nın bağlandığı mükemmel tamamlayıcı mesajları kesen bir endonükleaz içerir. Elde edilen mRNA parçaları daha sonra eksonükleazlar tarafından yok edilir. siRNA genellikle laboratuvarlarda hücre kültürlerinde genlerin fonksiyonlarını engellemek için kullanılır. Çift sarmallı RNA virüslerine karşı bir savunma olarak doğal bağışıklık sisteminin bir parçası olduğu düşünülmektedir.
MikroRNA (miRNA)
MikroRNA'lar (miRNA), genellikle metazoa mesajcı RNA'larındaki dizilere kısmen tamamlayıcı olan küçük RNA'lardır. Bir miRNA'nın bir mesaja bağlanması, bu mesajın çevirisini baskılayabilir ve poly(A) kuyruğunun çıkarılmasını hızlandırarak mRNA yıkımını hızlandırabilir. miRNA'ların etki mekanizması aktif araştırmaların konusudur.
Uygulamalar
Nükleozid modifiye edilmiş bir mesajcı RNA dizisinin verilmesi, bir hücrenin bir protein üretmesini sağlayabilir. Bu protein, doğrudan bir hastalığı tedavi edebilir veya bir aşı olarak işlev görebilir; dolaylı olarak ise bu protein, endojen kök hücrelerin istenilen şekilde farklılaşmasını sağlayabilir.
RNA tedavisinin temel zorlukları, RNA'nın uygun hücrelere teslim edilmesiyle ilgilidir. Zorluklar arasında, çıplak RNA dizilerinin hazırlanma sonrası doğal olarak bozulması; vücudun bu RNA dizilerini bir istilacı olarak algılayıp saldırıya geçirmesi; ve hücre zarından geçememeleri gibi sorunlar bulunmaktadır. Hücre içine girdikten sonra, RNA'nın sitoplazmada gerekli ribozomlarla harekete geçmeden önce hücrenin taşıma mekanizmasından çıkması gerekir.
Bu zorlukların üstesinden gelinmesiyle, mRNA terapisi ilk olarak 1989'da "geniş kapsamlı bir in vitro transfüzyon tekniği geliştirilmesinden sonra" önerilmiştir. 1990'larda, kişiselleştirilmiş kanserler için mRNA aşıları geliştirilmiş ve nükleozid modifiye edilmemiş mRNA'lara dayanmıştır. mRNA bazlı terapiler, hem kanser hem de otoimmun, metabolik ve solunum inflamatuar hastalıklar için bir tedavi veya terapi yöntemi olarak araştırılmaya devam etmektedir. Gen düzenleme terapileri, örneğin CRISPR, hücreleri istenilen Cas proteinini üretmeye teşvik etmek için mRNA kullanarak fayda sağlayabilir.
2010'lardan itibaren, RNA aşıları ve diğer RNA terapileri "yeni bir ilaç sınıfı" olarak değerlendirilmiştir. İlk mRNA bazlı aşılar, COVID-19 pandemisi sırasında Pfizer–BioNTech COVID-19 aşısı ve Moderna tarafından kısıtlı yetki almış ve dünya çapında uygulanmıştır. 2023 Nobel Fizyoloji veya Tıp Ödülü, COVID-19'a karşı etkili mRNA aşılarının geliştirilmesi için Katalin Karikó ve Drew Weissman'a verilmiştir.
Tarihçe
1950'lerin çeşitli moleküler biyoloji çalışmaları, RNA'nın protein sentezinde bir rol oynadığını gösterdi, ancak bu rolün tam olarak ne olduğu anlaşılmamıştı. Örneğin, Jacques Monod ve ekibi, RNA sentezinin, özellikle E. coli bakterisinde β-galaktosidaz enziminin üretimi sırasında protein sentezi için gerekli olduğunu göstermiştir. Arthur Pardee de 1954'te benzer RNA birikimlerini bulmuştur. 1953'te Alfred Hershey, June Dixon ve Martha Chase, E. coli'de sentezlendikten sonra hızla kaybolan bir sitozin içeren DNA (RNA olduğu belirtilmiş) tanımlamışlardır. Geriye dönüp bakıldığında, bu belki de mRNA'nın varlığının ilk gözlemlerinden biri olabilir, ancak o zamanlar böyle bir tanımlama yapılmamıştır.
mRNA fikri, ilk olarak 15 Nisan 1960'ta Sydney Brenner ve Francis Crick tarafından King's College, Cambridge'de geliştirilmiştir. François Jacob, Arthur Pardee ve Monod tarafından gerçekleştirilen bir deney hakkında bilgi verirken, bu deneyin mRNA'nın varlığını kanıtlamadığı ancak var olabileceği ihtimalini öne sürdüğü belirtilmiştir. Crick'in teşvikiyle, Brenner ve Jacob hemen bu yeni hipotezi test etmeye karar verdiler ve Matthew Meselson'dan yardım almak üzere California Teknoloji Enstitüsü'ne başvurdular. 1960 yazında, Brenner, Jacob ve Meselson, Caltech'teki Meselson laboratuvarında mRNA'nın varlığını kanıtlayan ilk deneyi gerçekleştirdiler. O sonbaharda, Jacob ve Monod "messenger RNA" (mesajcı RNA) ismini türettiler ve mRNA'nın işlevini açıklayan ilk teorik çerçeveyi geliştirdiler.
Şubat 1961'de, James Watson, Harvard merkezli araştırma grubunun benzer yönde sonuçlar gösteren bir dizi deneyle onlara çok yakın olduklarını açıkladı. Brenner ve diğerleri, Watson'un araştırma bulgularının yayınlanmasını erteleme talebini kabul ettiler. Sonuç olarak, Brenner ve Watson'ın makaleleri Mayıs 1961'de Nature dergisinin aynı sayısında eşzamanlı olarak yayımlandı, aynı ay içinde Jacob ve Monod, mRNA'nın teorik çerçevesini Journal of Molecular Biology'de yayınladılar.
Referanslar
- ^ "The Information in DNA Is Decoded by Transcription | Learn Science at Scitable". www.nature.com. Retrieved 2024-05-03.
- ^ "RNA world (article) | Natural selection". Khan Academy. Retrieved 2024-05-03.
- ^ "The presence of thymine the place of uracil also confers additional stability to DNA. How?". Toppr Ask. Retrieved 2024-05-04.
- ^ Watson JD (February 22, 2013). Molecular Biology of the Gene, 7th edition. Pearson Higher Ed USA. ISBN 9780321851499.
- ^ Choi YS, Patena W, Leavitt AD, McManus MT (March 2012). "Widespread RNA 3'-end oligouridylation in mammals". RNA. 18 (3): 394–401. doi:10.1261/rna.029306.111. PMC 3285928. PMID 22291204.
- ^ Quaresma AJ, Sievert R, Nickerson JA (April 2013). "Regulation of mRNA export by the PI3 kinase/AKT signal transduction pathway". Molecular Biology of the Cell. 24 (8): 1208–1221. doi:10.1091/mbc.E12-06-0450. PMC 3623641. PMID 23427269.
- ^ Kierzkowski D, Kmieciak M, Piontek P, Wojtaszek P, Szweykowska-Kulinska Z, Jarmolowski A (September 2009). "The Arabidopsis CBP20 targets the cap-binding complex to the nucleus, and is stabilized by CBP80". The Plant Journal. 59 (5): 814–825. doi:10.1111/j.1365-313X.2009.03915.x. PMID 19453442.
- ^ Strässer K, Masuda S, Mason P, Pfannstiel J, Oppizzi M, Rodriguez-Navarro S, Rondón AG, Aguilera A, Struhl K, Reed R, Hurt E (May 2002). "TREX is a conserved complex coupling transcription with messenger RNA export". Nature. 417 (6886): 304–308. Bibcode:2002Natur.417..304S. doi:10.1038/nature746. PMID 11979277. S2CID 1112194.
- ^ Katahira J, Yoneda Y (27 October 2014). "Roles of the TREX complex in nuclear export of mRNA". RNA Biology. 6 (2): 149–152. doi:10.4161/rna.6.2.8046. PMID 19229134.
- ^ Cenik C, Chua HN, Zhang H, Tarnawsky SP, Akef A, Derti A, Tasan M, Moore MJ, Palazzo AF, Roth FP (April 2011). "Genome analysis reveals interplay between 5'UTR introns and nuclear mRNA export for secretory and mitochondrial genes". PLOS Genetics. 7 (4): e1001366. doi:10.1371/journal.pgen.1001366. PMC 3077370. PMID 21533221.
- ^ Steward O, Levy WB (March 1982). "Preferential localization of polyribosomes under the base of dendritic spines in granule cells of the dentate gyrus". The Journal of Neuroscience. 2 (3): 284–291. doi:10.1523/JNEUROSCI.02-03-00284.1982. PMC 6564334. PMID 7062109.
- ^ Steward O, Worley PF (April 2001). "Selective targeting of newly synthesized Arc mRNA to active synapses requires NMDA receptor activation". Neuron. 30 (1): 227–240. doi:10.1016/s0896-6273(01)00275-6. PMID 11343657. S2CID 13395819.
- ^ Job C, Eberwine J (December 2001). "Localization and translation of mRNA in dendrites and axons". Nature Reviews. Neuroscience. 2 (12): 889–898. doi:10.1038/35104069. PMID 11733796. S2CID 5275219.
- ^ Oleynikov Y, Singer RH (February 2003). "Real-time visualization of ZBP1 association with beta-actin mRNA during transcription and localization". Current Biology. 13 (3): 199–207. Bibcode:2003CBio...13..199O. doi:10.1016/s0960-9822(03)00044-7. PMC 4765734. PMID 12573215.
- ^ Hüttelmaier S, Zenklusen D, Lederer M, Dictenberg J, Lorenz M, Meng X, et al. (November 2005). "Spatial regulation of beta-actin translation by Src-dependent phosphorylation of ZBP1". Nature. 438 (7067): 512–515. Bibcode:2005Natur.438..512H. doi:10.1038/nature04115. PMID 16306994. S2CID 2453397.
- ^ Oleynikov Y, Singer RH (October 1998). "RNA localization: different zipcodes, same postman?". Trends in Cell Biology. 8 (10): 381–383. doi:10.1016/s0962-8924(98)01348-8. PMC 2136761. PMID 9789325.
- ^ Ainger K, Avossa D, Diana AS, Barry C, Barbarese E, Carson JH (September 1997). "Transport and localization elements in myelin basic protein mRNA". The Journal of Cell Biology. 138 (5): 1077–1087. doi:10.1083/jcb.138.5.1077. PMC 2136761. PMID 9281585.
- ^ Haimovich G, Ecker CM, Dunagin MC, Eggan E, Raj A, Gerst JE, Singer RH (November 2017). "Intercellular mRNA trafficking via membrane nanotube-like extensions in mammalian cells". Proceedings of the National Academy of Sciences of the United States of America. 114 (46): E9873–E9882. Bibcode:2017PNAS..114E9873H. doi:10.1073/pnas.1706365114. PMC 5699038. PMID 29078295.
- ^ Haimovich G, Dasgupta S, Gerst JE (February 2021). "RNA transfer through tunneling nanotubes". Biochemical Society Transactions. 49 (1): 145–160. doi:10.1042/BST20200113. PMID 33367488. S2CID 229689880.
- ^ Lin CY, Beattie A, Baradaran B, Dray E, Duijf PH (September 2018). "Contradictory mRNA and protein misexpression of EEF1A1 in ductal breast carcinoma due to cell cycle regulation and cellular stress". Scientific Reports. 8 (1): 13904. Bibcode:2018NatSR...813904L. doi:10.1038/s41598-018-32272-x. PMC 6141510. PMID 30224719.
- ^ Shabalina SA, Ogurtsov AY, Spiridonov NA (2006). "A periodic pattern of mRNA secondary structure created by the genetic code". Nucleic Acids Research. 34 (8): 2428–2437. doi:10.1093/nar/gkl287. PMC 1458515. PMID 16682450.
- ^ Katz L, Burge CB (September 2003). "Widespread selection for local RNA secondary structure in coding regions of bacterial genes". Genome Research. 13 (9): 2042–2051. doi:10.1101/gr.1257503. PMC 403678. PMID 12952875.
- ^ Lu YF, Mauger DM, Goldstein DB, Urban TJ, Weeks KM, Bradrick SS (November 2015). "IFNL3 mRNA structure is remodeled by a functional non-coding polymorphism associated with hepatitis C virus clearance". Scientific Reports. 5: 16037. Bibcode:2015NatSR...516037L. doi:10.1038/srep16037. PMC 4631997. PMID 26531896.
- ^ a b Kozak M (March 1983). "Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles". Microbiological Reviews. 47 (1): 1–45. doi:10.1128/MMBR.47.1.1-45.1983. PMC 281560. PMID 6343825.














0 Yorumlar