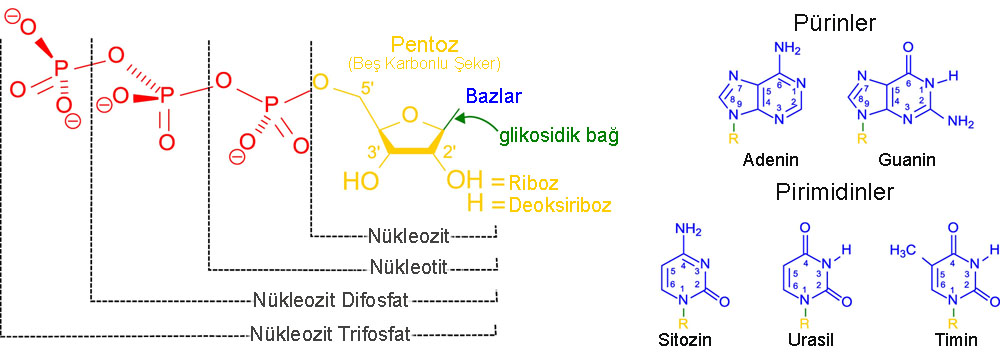
Nükleotidler üç alt birim molekülden oluşur: bir nükleobaz, beş karbonlu bir şeker (riboz veya deoksiriboz) ve bir ila üç fosfattan oluşan bir fosfat grubu. DNA'daki dört nükleobaz guanin, adenin, sitozin ve timindir; RNA'da timin yerine urasil kullanılır.
Nükleotidler, hücresel düzeyde temel bir rol oynarlar ve metabolizmanın merkezinde yer alırlar. Hücre içinde enerji gerektiren birçok işlev için, kimyasal enerji—adenozin trifosfat (ATP), guanozin trifosfat (GTP), sitidin trifosfat (CTP) ve uridin trifosfat (UTP) gibi nükleozid trifosfatlar şeklinde—sağlarlar. Bu işlevler arasında amino asit, protein ve hücre zarı sentezi, hücre ve hücre parçalarının hareketi (hem hücre içi hem de hücreler arası), hücre bölünmesi vb. bulunur. Ayrıca, nükleotidler hücre sinyalizasyonuna katılır (siklik guanozin monofosfat veya cGMP ve siklik adenozin monofosfat veya cAMP) ve enzimatik reaksiyonların önemli kofaktörlerine (ör. koenzim A, FAD, FMN, NAD ve NADP+) dahil edilirler.
Deneysel biyokimyada, nükleotidler radyoizotoplarla işaretlenerek radyoaktif nükleotidler elde edilebilir.
Ayrıca, 5-nükleotidler, umami tadını artırmak için bir maya ekstresi şeklinde lezzet artırıcı gıda katkı maddesi olarak da kullanılır.
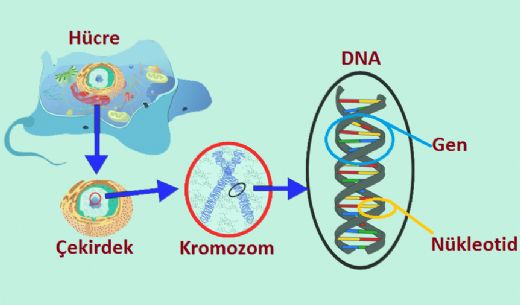
Nükleotit Yapısı
Bir nükleotid, üç ayırt edici kimyasal alt birimden oluşur: beş karbonlu bir şeker molekülü, bir nükleobaz (bu ikisi birlikte nükleozid olarak adlandırılır) ve bir fosfat grubu. Bu üçü bir araya geldiğinde, nükleotid, kaç fosfatın fosfat grubunu oluşturduğuna bağlı olarak "nükleozid monofosfat", "nükleozid difosfat" veya "nükleozid trifosfat" olarak da adlandırılır.
Nükleik asitlerde, nükleotidler ya bir pürin ya da bir pirimidin bazı içerir—yani, nükleobaz molekülü, aynı zamanda azotlu baz olarak da bilinir—ve şeker riboz ise ribonükleotid, deoksiriboz ise deoksiribonükleotid olarak adlandırılır. Bireysel fosfat molekülleri, iki bitişik nükleotid monomerindeki şeker halkası moleküllerini tekrar tekrar bağlar, böylece bir nükleik asidin nükleotid monomerlerini uç uca uzun bir zincir halinde birleştirir. Bu şeker ve fosfat moleküllerinin zincir-bağlantıları, tek veya çift sarmal için bir 'omurga' zinciri oluşturur. Herhangi bir zincirde, zincir-bağlantılarının kimyasal yönelimi (yönlülüğü) 5'-uçtan 3'-uça doğru gider—bu, bitişik nükleotidlerdeki şeker moleküllerinin beş karbon bölgelerine atıfta bulunur. Çift sarmalda, iki zincir zıt yönlerde yer alır, bu da baz eşleşmesini ve baz çiftleri arasında tamamlayıcılığı mümkün kılar; tüm bunlar, DNA'da bulunan kodlanmış bilginin çoğaltılması veya transkripsiyonu için esastır.
Nükleik asitler, nükleotidlerden oluşan polimerik makromoleküllerdir; nükleotidler, nükleik asitlerin monomer birimleridir. Hem DNA hem de RNA'da yer alan pürin bazları adenin ve guanin ile pirimidin bazı sitozin, DNA'da sadece timin ve RNA'da sadece urasil olarak yer alır. Adenin, timin ile iki hidrojen bağı ile bir baz çifti oluştururken, guanin, sitozin ile üç hidrojen bağı ile eşleşir.
Nükleik asit polimerlerinin yapım blokları olmanın yanı sıra, tekil nükleotidler hücresel enerji depolama ve sağlama, hücresel sinyalizasyon, proteinlerin ve diğer sinyal moleküllerinin aktivitesini modüle etmek için fosfat gruplarının kaynağı olarak ve enzimatik kofaktörler olarak rol oynar, genellikle redoks reaksiyonları gerçekleştirir. Sinyalizasyon döngüsel nükleotidler, fosfat grubunun aynı şeker molekülüne iki kez bağlanmasıyla oluşur ve şekerin 5'- ve 3'- hidroksil gruplarını birleştirir. Bazı sinyal nükleotidleri, standart tek fosfat grubu yapılandırmasından farklı olarak, şekerin farklı pozisyonlarına bağlı birden fazla fosfat grubu içerir. Nükleotid kofaktörleri, glikozidik bağ yoluyla şekere bağlı daha geniş bir kimyasal grup yelpazesi içerir; bunlar arasında nikotinamid ve flavin bulunur ve son durumda, riboz şekeri, diğer nükleotidlerde görülen halkayı oluşturmak yerine lineer bir yapıdadır.
Nükleotit Sentezi
In Vitro Sentez: Laboratuvar ortamında, nükleotidlerin üretimi sırasında koruma grupları kullanılabilir. Saflaştırılmış bir nükleozid, bir fosforamidit oluşturmak için korunur. Bu fosforamidit daha sonra doğada bulunmayan analogları elde etmek ve/veya bir oligonükleotid sentezlemek için kullanılabilir.
In Vivo Sentez: Nükleotidler, hücre içinde ya de novo sentez yoluyla ya da kurtarma yolları (salvage pathways) aracılığıyla geri dönüştürülerek sentezlenebilir. De novo nükleotid sentezi için kullanılan bileşenler, karbonhidrat ve amino asit metabolizmasının biyosentetik öncülerinden, ayrıca amonyak ve karbondioksitten türetilir. Yakın zamanda, hücresel bikarbonat metabolizmasının mTORC1 sinyali ile düzenlenebileceği gösterilmiştir. Karaciğer, tüm dört nükleotidin de novo sentezinin başlıca organıdır.
Pirimidin ve Pürin Sentez Yolları:
- Pirimidinler: İlk olarak sitoplazmada aspartat ve karbamoil-fosfattan ortak bir öncü halka yapısı olan orotik asit sentezlenir. Bu yapıya, fosforile bir ribozil birimi kovalent olarak bağlanır.
- Pürinler: İlk olarak şeker şablonundan sentezlenir ve bu şablon üzerine halka sentezi gerçekleşir.
Pirimidin ve pürin nükleotidlerinin sentezleri, hücrenin sitoplazmasında, belirli bir organel içinde değil, birden fazla enzim tarafından gerçekleştirilir. Nükleotidler, yararlı parçaların yeni nükleotidlerin sentezi için yeniden kullanılabileceği şekilde yıkılır.
Pirimidin Ribonükleotid Sentezi
Pirimidin Metabolizması: Pirimidinlerin sentezi sitoplazmada gerçekleşir ve karbamoil fosfatın glutamin ve CO₂'den oluşumu ile başlar. Ardından, aspartat karbamoiltransferaz enzimi, aspartat ve karbamoil fosfat arasında bir kondenzasyon reaksiyonunu katalize eder ve karbamoil aspartik asit oluşturur. Bu bileşik, dihidroorotaz tarafından 4,5-dihidroorotik aside döngüsel hale getirilir. Sonrasında, dihidroorotat oksidaz enzimi tarafından orotata dönüştürülür. Net reaksiyon şu şekildedir:
Orotatın Ribozile Bağlanması: Orotat, fosforile bir ribozil birimi ile kovalent olarak bağlanır. Riboz ve pirimidin arasındaki kovalent bağ, riboz biriminin C1 pozisyonunda (pyrofosfat içeren) ve pirimidin halkasının N1 pozisyonunda gerçekleşir. Orotat fosforibosiltransferaz (PRPP transferaz) enzimi, orotidin monofosfat (OMP) oluşturmak için net reaksiyonu katalize eder:
UMP'nin Oluşumu: Orotidin 5'-monofosfat, orotidin-5'-fosfat dekarboksilaz enzimi tarafından dekarboksile edilerek uridin monofosfat (UMP) oluşturur. PRPP transferaz, PRPP varlığında orotik asitten UMP oluşumunda hem ribozilasyon hem de dekarboksilasyon reaksiyonlarını katalize eder. Diğer pirimidin nükleotidleri UMP'den türetilir. UMP, ATP ile yapılan iki ardışık reaksiyonla iki kinaz tarafından uridin trifosfata (UTP) fosforile edilir. İlk olarak, UDP'den diphosfat üretilir, ardından bu bileşik UTP'ye fosforile edilir. Her iki adım da ATP hidrolizi ile gerçekleştirilir:
CTP'nin Oluşumu: CTP, UTP'nin CTP sentaz enzimi tarafından amine edilmesiyle oluşur. Glutamin, NH₃ donörüdür ve bu reaksiyon da ATP hidrolizi ile gerçekleşir:
CMP'nin Türemesi: Sitozin monofosfat (CMP), sitozin trifosfattan (CTP) iki fosfatın kaybı ile türetilir.
Bu biyokimyasal süreçler, pirimidin nükleotidlerinin sentezlenmesini ve hücresel fonksiyonlarda kullanılmasını sağlar, böylece DNA ve RNA biyosentezinde merkezi bir rol oynar.Pürin Ribonükleotid Sentezi
Pürin nükleotidlerinin de novo sentezi, pürin halkasının oluşturulması için on adımlı bir yolu takip eder ve bu süreçte prekürsörler pürin halkasına dahil edilir. Bu yolun sonunda, ara madde olarak inosinat (IMP) oluşturulur. IMP, baz olarak hipoksantin içeren bir nükleotiddir. Bu ara maddeden, AMP ve GMP ayrı iki basamaklı yollarla sentezlenir. Bu nedenle, pürin bileşenleri başlangıçta serbest bazlar olarak değil, ribonükleotidlerin bir parçası olarak oluşur.
IMP Sentezinde Yer Alan Enzimler:
IMP sentezi altı enzim tarafından gerçekleştirilir ve bu enzimlerden üçü çok fonksiyonludur:
- GART (reactions 2, 3, and 5): Birden fazla adımı katalize eden enzimlerdendir.
- PAICS (reactions 6, and 7): Çeşitli pürin sentezi adımlarında rol oynar.
- ATIC (reactions 9, and 10): Sentezin son aşamalarında görev alır.
Pürin Sentezinin Adımları:
- PRPP'nin Oluşumu: Yolağın başlangıcında, PRPP (5-fosforibosil-1-pirofosfat) oluşur. Bu, pentoz fosfat yoluyla başlıca olarak üretilen riboz-5-fosfatın PRPP'ye dönüşümünü sağlar. PRPP, ATP ile reaksiyona girer ve bu işlem PRPS1 enzimi tarafından katalize edilir. Bu reaksiyon, ATP’den bir pirofosfat grubunun doğrudan riboz-5-fosfatın C1 atomuna transfer edilmesiyle gerçekleşir ve ürün C1 etrafında α konfigürasyonuna sahiptir. Bu reaksiyon, Trp, His ve pirimidin nükleotidlerinin sentez yollarıyla da ortaktır. Önemli bir metabolik kavşak üzerinde olması ve yüksek enerji gerektirmesi nedeniyle bu reaksiyon sıkı bir şekilde düzenlenir.
- Özel Pürin Sentezi Adımı: Pürin nükleotid biyosentezine özgü ilk reaksiyonda, PRPP'nin pirofosfat grubu (PPi), glutamin, glisin, aspartat, folik asit veya CO2’den gelen bir amid nitrojeni tarafından yer değiştirir. Bu adım, pürin sentezinde "commitment" (adanmışlık) adımı olarak kabul edilir. Reaksiyon, riboz C1 etrafında konfigürasyonun tersine dönmesiyle gerçekleşir ve böylece β-5-fosforibozilamin (5-PRA) oluşur ve gelecekteki nükleotidin anomerik formu oluşturulur.
- Glycin Eklenmesi: Daha sonra, ATP hidrolizi ile güçlendirilmiş bir glisin eklenir ve karboksil grubu, daha önce eklenmiş NH2 grubuna bir amin bağı oluşturur.
- İmidazol Halka Kapanışı: Folic acid koenzimi N10-formil-THF’den bir karbon birimi, glisinin amino grubuna eklenir ve imidazol halkasının kapanmasını sağlar. Ardından, glutaminden ikinci bir NH2 grubu glisin biriminin ilk karbonuna transfer edilir. Eşzamanlı olarak glisin biriminin ikinci karbonuna bir karboksil grubu eklenir.
- Aspartat ve Formil-THF Eklemeleri: Yeni eklenen karbona üçüncü bir NH2 birimi, bu kez bir aspartat kalıntısından transfer edilir. Son olarak, formil-THF’den ikinci bir karbon birimi azot grubuna eklenir ve halka, ortak pürin öncüsü inosinat monofosfatı (IMP) oluşturmak üzere kovalent olarak kapanır.
IMP'den AMP ve GMP'nin Sentezi:
- AMP Sentezi: İnosin monofosfat, iki adımda adenozin monofosfat (AMP) haline dönüştürülür. İlk olarak, GTP hidrolizi, adenilosuksinat sentaz tarafından IMP'ye aspartat eklenmesini sağlar, karbonil oksijenin yerine bir azot alarak ara madde adenilosuksinatı oluşturur. Daha sonra, adenilosuksinat liyaz tarafından fumarat ayrılır ve AMP oluşur.
- GMP Sentezi: İnosin monofosfat, oksidasyonla xanthylate (XMP) haline getirilerek ve ardından C2'de bir amino grubunun eklenmesiyle guanozin monofosfat (GMP) haline dönüştürülür. Oksidasyon reaksiyonunda NAD⁺ elektron kabul edicidir. Glutaminden amid grup transferi ATP hidrolizi ile sağlanır.
Bu süreç, hücresel enerji metabolizması ve DNA ile RNA sentezinde kritik öneme sahip olan AMP ve GMP gibi temel pürin nükleotidlerinin oluşturulmasını sağlar.
Sentetik Nükleotidlerin Tıbbi Uygulamaları
Sentetik nükleotidlerin geniş bir tıbbi uygulama alanı vardır ve bu uygulamalar hastalık teşhisi, tedavisi ve hassas tıbbı içerir. Sentetik nükleotidlerin doğal nükleik asitleri taklit etme veya onlara müdahale etme yeteneği, hedefe yönelik tedavi stratejilerini mümkün kılar. İşte bazı önemli uygulamalar:
- Antiviral veya Antiretroviral Ajanlar: Sentetik nükleotid türevleri, Hepatit ve HIV gibi viral enfeksiyonların tedavisinde yaygın olarak kullanılır. Bu sentetik bileşikler, viral nükleik asit sentezine müdahale ederek viral replikasyonu inhibe edebilir.
- Nükleozid Analog Ters Transkriptaz İnhibitörleri (NRTI'lar): Tenofovir disoproksil, Tenofovir alafenamid ve Sofosbuvir gibi ilaçlar, HIV gibi virüslerin çoğalması için gerekli olan ters transkriptazı inhibe eden doğrudan nükleozid analoglarıdır. Bu inhibitörler, viral DNA'ya doğal nükleotidler gibi dahil olarak, zincir sonlandırmasına veya hatalı replikasyona neden olur.
- Fosforile Ajanlar: Diğer ajanlar ise aktif hale gelmek için fosforilasyon yoluyla metabolize edilmelidir. Bu ajanlar, fosfat grupları eklenerek aktif formuna dönüşür ve bu şekilde antiviral etkilerini gösterirler.
- Antisens Oligonükleotidler (ASO): Sentetik oligonükleotidler, belirli RNA transkriptlerine bağlanarak protein ifadesini düzenleyebilir ve bu nedenle nadir kalıtsal hastalıkların tedavisinde kullanılır. Omurilik kas atrofisi, amyotrofik lateral skleroz, homozigot ailesel hiperkolesterolemi ve birincil hiperoksalüri tip 1, ASO tabanlı tedaviye uygun hastalıklar arasında yer alır. Oligonükleotidlerin uygulanması, tedavi edilemeyen durumların yönetiminde hassas tıbbın yeni bir sınırını temsil eder.
- Sentetik Kılavuz RNA (gRNA): Sentetik nükleotidler, CRISPR-Cas9 gibi gen düzenleme teknolojilerinin düzgün çalışması için gerekli olan kılavuz RNA'nın (gRNA) tasarlanmasında kullanılabilir. Bu kılavuz RNA'lar, hedeflenen DNA bölgelerine bağlanarak, gen düzenleme işlemlerinin hassasiyetini ve etkinliğini artırır.
Referanslar
- Zaharevitz DW, Anderson LW, Malinowski NM, Hyman R, Strong JM, Cysyk RL (November 1992). "Contribution of de-novo and salvage synthesis to the uracil nucleotide pool in mouse tissues and tumors in vivo". European Journal of Biochemistry. 210 (1): 293–6. doi:10.1111/j.1432-1033.1992.tb17420.x. PMID 1446677.
- ^ a b Alberts B, Johnson A, Lewis J, Raff M, Roberts K & Walter P (2002). Molecular Biology of the Cell (4th ed.). Garland Science. ISBN 0-8153-3218-1. pp. 120–121.
- ^ Abd El-Aleem FS, Taher MS, Lotfy SN, El-Massry KF, Fadel HH (2017-12-18). "Influence of extracted 5-nucleotides on aroma compounds and flavour acceptability of real beef soup". International Journal of Food Properties. 20 (sup1): S1182–S1194. doi:10.1080/10942912.2017.1286506. S2CID 100497537.
- ^ Wiley (2005-09-09). Encyclopedia of Life Sciences (1 ed.). Wiley. doi:10.1002/9780470015902.a0001333.pub3. ISBN 978-0-470-01617-6.
- ^ Smith AD, ed. (2000). Oxford Dictionary of Biochemistry and Molecular Biology (Revised ed.). Oxford: Oxford University Press. p. 460.
- ^ Ali E, Liponska A, O'Hara B, Amici D, Torno M, Gao P, et al. (June 2022). "The mTORC1-SLC4A7 axis stimulates bicarbonate import to enhance de novo nucleotide synthesis". Molecular Cell. 82 (1): 3284–3298.e7. doi:10.1016/j.molcel.2022.06.008. PMC 9444906. PMID 35772404.
- ^ See IUPAC nomenclature of organic chemistry for details on carbon residue numbering
- ^ Jones ME (1980). "Pyrimidine nucleotide biosynthesis in animals: genes, enzymes, and regulation of UMP biosynthesis". Annual Review of Biochemistry. 49 (1): 253–79. doi:10.1146/annurev.bi.49.070180.001345. PMID 6105839.
- ^ McMurry JE, Begley TP (2005). The organic chemistry of biological pathways. Roberts & Company. ISBN 978-0-9747077-1-6.
- ^ a b Becker S, Feldmann J, Wiedemann S, Okamura H, Schneider C, Iwan K, et al. (October 2019). "Unified prebiotically plausible synthesis of pyrimidine and purine RNA ribonucleotides". Science. 366 (6461): 76–82. Bibcode:2019Sci...366...76B. doi:10.1126/science.aax2747. PMID 31604305. S2CID 203719976.










0 Yorumlar