DNA Metilasyonunun Kanser Hücrelerindeki Rolü: Epigenetik Mekanizmaların Kanser Tedavisindeki Potansiyeli
Kanser, dünya genelinde yüksek morbidite ve mortalite oranlarına sahip, heterojen ve kompleks bir hastalık grubudur. Genetik mutasyonların yanı sıra epigenetik değişiklikler de kanser patogenezi üzerinde belirleyici bir rol oynar. Epigenetik, DNA diziliminde herhangi bir değişiklik olmaksızın gen ekspresyonunu düzenleyen mekanizmaları inceleyen bir bilim dalıdır. Bu mekanizmalardan biri olan DNA metilasyonu, kanser hücrelerinin oluşumu, progresyonu ve tedavisi açısından kritik öneme sahiptir. Bu yazıda, DNA metilasyonunun kanser hücrelerindeki etkileri ve epigenetik mekanizmaların onkolojik tedavi potansiyeli üzerinde ayrıntılı bir şekilde durulacaktır.
DNA Metilasyonu: Mekanizma, Fonksiyon ve Moleküler Dinamikler
DNA metilasyonu, sitozin bazının 5. karbon atomuna bir metil grubunun eklenmesiyle oluşur ve çoğunlukla CpG dinükleotid bölgelerinde meydana gelir. CpG adacıkları, genellikle promotör bölgelerde yoğunlaşır ve gen ekspresyonunu düzenleyici özellik taşır.
Fizyolojik şartlarda DNA metilasyonu, hücre farklılaşması, genomik stabilite ve epigenetik hafızanın korunması için hayati öneme sahiptir. Özellikle embriyonik gelişimde ve genomik imprinting mekanizmalarında bu süreç kritik rol oynar. Ayrıca X kromozomu inaktivasyonu gibi süreçlerde de DNA metilasyonu işlevseldir. Ancak, bu mekanizmanın disfonksiyonu, onkogenezin temel patolojik süreçlerinden biri olarak karşımıza çıkar.
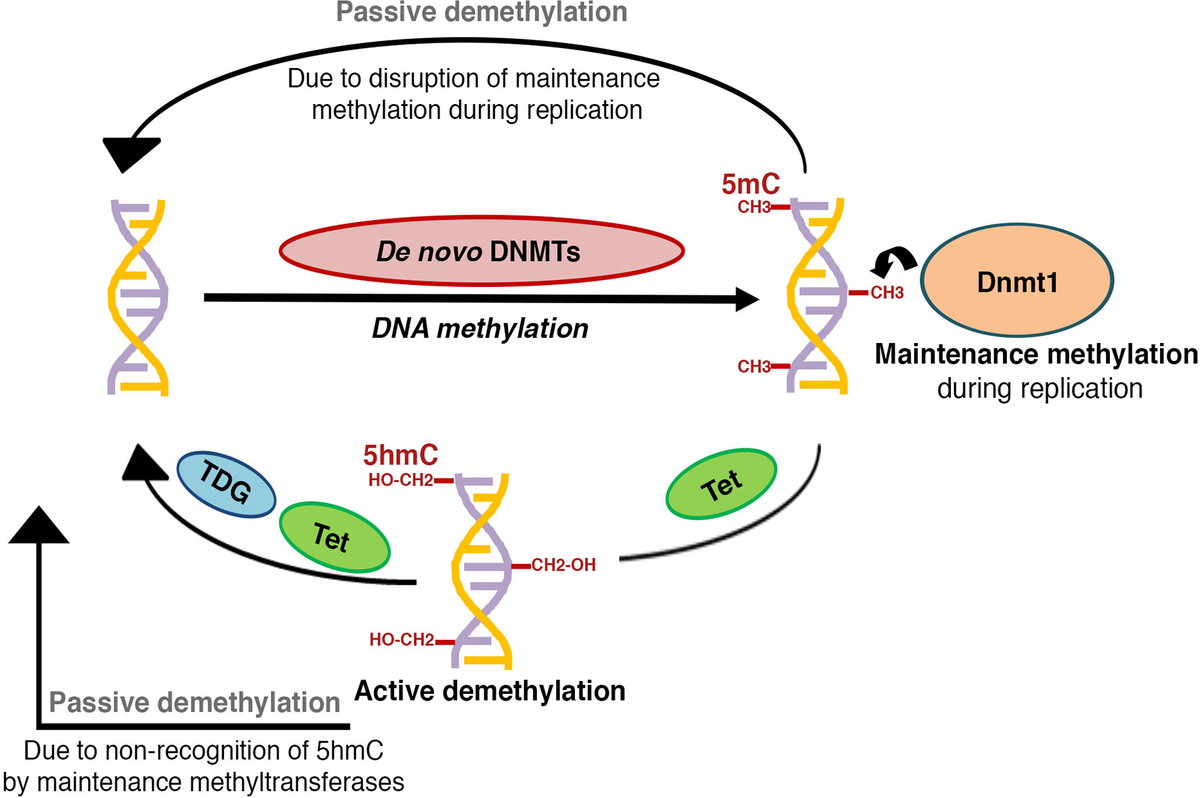
DNA metilasyonu, DNMT (DNA metiltransferaz) ailesine ait enzimler tarafından gerçekleştirilir. DNMT1, DNMT3A ve DNMT3B enzimleri, epigenetik kodun dinamik bir şekilde düzenlenmesini sağlar. DNMT1, özellikle mitoz sırasında metilasyon paternlerini korurken, DNMT3A ve DNMT3B yeni metilasyon paternlerini oluşturur. Daha fazla bilgi için tıklayınız.
Kanserde DNA Metilasyon Dinamikleri
Kanser hücrelerinde DNA metilasyon paternleri normal hücrelerden belirgin şekilde farklılık gösterir ve bu farklılıklar genellikle üç ana kategoride incelenir:
Global Hipometilasyon:
Tümör hücrelerinde genom çapında metilasyon kaybı sıkça gözlemlenir. Bu durum, genomik instabiliteye yol açarak retrotranspozonların aktivasyonunu tetikler ve tümör progresyonunu destekler. Hipometilasyonun, özellikle heterokromatin bölgelerinde meydana gelerek proto-onkogenleri aktive ettiği gösterilmiştir.Lokal Hipermetilasyon:
Gen promotör bölgelerinde meydana gelen anormal hipermetilasyon, tümör baskılayıcı genlerin susturulmasına sebep olur. Özellikle p16INK4a, BRCA1 ve MLH1 gibi genlerdeki metilasyon artışı, DNA tamir mekanizmalarını sekteye uğratır ve kanserojenik süreçleri hızlandırır. Bu durum, genellikle epigenetik sessizleştirme ile ilişkilidir.Non-CpG Metilasyonu:
Son araştırmalar, özellikle kök hücrelerde ve bazı kanser türlerinde non-CpG metilasyonunun da rol oynayabileceğini göstermektedir. Bu süreç, genellikle DNMT3A ve DNMT3B enzimleri aracılığıyla gerçekleşir.Kanser Alt Tiplerinde DNA Metilasyon Profilleri ve Klinik Relevans
Kanser türlerine özgü metilasyon paternleri, klinik tanı ve tedavi açısından önemli bilgiler sunar. Örnekler:
Meme Kanseri: BRCA1 promotöründe hipermetilasyon, DNA tamir mekanizmalarının bozulmasına neden olur. Özellikle triple negatif meme kanserinde bu patern daha sık görülür.
Kolorektal Kanser: MLH1 genindeki hipermetilasyon, mikrosatellit instabilitesi ile ilişkilidir. CpG island methylator phenotype (CIMP) olarak adlandırılan bu epigenetik profil, prognostik ve prediktif önem taşır.Akciğer Kanseri: RASSF1A geninin metilasyonu, tümör gelişimi açısından belirleyici bir biyomarker olarak değerlendirilir. Sigara kaynaklı akciğer kanserlerinde bu metilasyon profili daha sık görülmektedir.
Prostat Kanseri: GSTP1 genindeki hipermetilasyon, prostat kanseri için yaygın olarak gözlemlenen epigenetik bir değişikliktir.
DNA Metilasyonunun Tanısal Kullanımı: Epigenetik Biyobelirteçler
Epigenetik imzalar, özellikle DNA metilasyon paternleri, kanserin erken tanısı için umut vadeden biyobelirteçlerdir. Metilasyon temelli biyomarker analizleri, non-invaziv yöntemlerle uygulanabilir ve tanı doğruluğunu artırabilir.
Tanı Teknikleri
Methylation-Specific PCR (MSP): Spesifik bölgelerdeki metilasyon durumunu saptamak için kullanılır. Özellikle meme, akciğer ve kolorektal kanserlerde rutin olarak kullanılır.
Bisülfit Sekanslama: DNA'daki metilasyon durumunu detaylı olarak analiz eder. Bu teknik, genom çapında epigenomik haritalama için de kullanılabilir.Likid Biyopsi: Serum veya plazmada hücresiz DNA'daki (cfDNA) metilasyon paternlerini inceleyerek kanserin erken teşhisine olanak sağlar. Kanserin dinamik takibi ve tedavi yanıtının izlenmesi için ideal bir yöntemdir.
DNA Metilasyonunun Kanser Tedavisindeki Potansiyeli
Kanser tedavisinde epigenetik mekanizmaların hedeflenmesi, geleneksel tedavilere karşı direnç geliştiren vakalarda alternatif yaklaşımlar sunmaktadır. Epigenetik ilaçlar, metilasyon profillerini modüle ederek kanserin ilerleyişini durdurma potansiyeline sahiptir.
Epigenetik İlaçlar
DNMT İnhibitörleri: DNA metiltransferaz enzimlerini inhibe ederek anormal metilasyon paternlerini düzenler.
5-Azacitidin (Vidaza) ve Decitabin (Dacogen): MDS ve AML tedavisinde klinik etkinliği kanıtlanmıştır.Guadecitabin: Klinik çalışmalarda umut vaat eden yeni nesil bir DNMT inhibitörüdür.
HDAC İnhibitörleri: Histon deasetilazları inhibe ederek kromatin yapısını gevşetir ve gen ekspresyonunu düzenler.
Vorinostat ve Romidepsin: FDA onaylı ilaçlar olup T-hücreli lenfoma tedavisinde kullanılır.EZH2 İnhibitörleri: Histon metiltransferaz EZH2'yi hedef alarak özellikle lenfomalar ve solid tümörlerde epigenetik modifikasyonu sağlar.
Kişiselleştirilmiş Epigenetik Tedavi ve Bireyselleştirilmiş Onkoloji
Epigenetik imzaların bireyler arası farklılık göstermesi, kişiselleştirilmiş tedavi yaklaşımlarının geliştirilmesine zemin hazırlamaktadır. Tümör spesifik metilasyon profilleri analiz edilerek hastaya özgü terapötik planlar oluşturulabilmektedir. Bu kapsamda, epigenomik verilerin büyük veri analizleri ile değerlendirilmesi ve kişiselleştirilmiş terapilerin geliştirilmesi hedeflenmektedir.
Gelecek Perspektifi: Epigenetik Araştırmaların Yönü
Epigenetik çalışmalar, kanser araştırmalarında yeni ufuklar açmaya devam etmektedir. CRISPR/Cas9 tabanlı epigenetik düzenleme teknikleri, gen ekspresyonunun doğrudan modifikasyonunu mümkün kılmaktadır. Yapay zeka algoritmalarının epigenetik veri analizine entegre edilmesi ise daha isabetli tanı ve tedavi stratejileri geliştirilmesine katkı sağlayacaktır.
Son yıllarda, multi-omik yaklaşımların kullanımıyla epigenetik, genetik, transkriptomik ve proteomik verilerin entegre edilmesi, kanser biyolojisini daha derinlemesine anlamamıza olanak tanımaktadır.
Sonuç
DNA metilasyonu, kanser biyolojisinin anlaşılmasında ve tedavi seçeneklerinin geliştirilmesinde kritik bir role sahiptir. Metilasyon paternlerinin detaylı incelenmesi, kanserin moleküler düzeyde daha iyi anlaşılmasını sağlamış ve epigenetik temelli terapötik yaklaşımların geliştirilmesine zemin hazırlamıştır. Gelecekte epigenetik tedavi yaklaşımlarının daha geniş bir klinik uygulama alanı bulması beklenmektedir. Kanser araştırmalarında epigenetik imzaların dinamik olarak izlenmesi ve tedavi süreçlerine entegrasyonu, onkolojik tedavi başarı oranlarını artırma potansiyeline sahiptir.
Kaynakça
- Esteller, M. (2007). Epigenetics in cancer. New England Journal of Medicine, 358(11), 1148-1159. https://doi.org/10.1056/NEJMra072067
- Jones, P. A., & Baylin, S. B. (2002). The fundamental role of epigenetic events in cancer. Nature Reviews Genetics, 3(6), 415-428. https://doi.org/10.1038/nrg816
- Sharma, S., Kelly, T. K., & Jones, P. A. (2010). Epigenetics in cancer. Carcinogenesis, 31(1), 27-36. https://doi.org/10.1093/carcin/bgp220
- Baylin, S. B., & Jones, P. A. (2016). A decade of exploring the cancer epigenome—biological and translational implications. Nature Reviews Cancer, 16(6), 360-380. https://doi.org/10.1038/nrc.2016.35
- You, J. S., & Jones, P. A. (2012). Cancer genetics and epigenetics: Two sides of the same coin?. Cancer Cell, 22(1), 9-20. https://doi.org/10.1016/j.ccr.2012.06.008





0 Yorumlar